
Vocabulario

1. Orbitales Híbridos:
-
La combinación de orbitales atómicos dentro de un átomo para formar nuevos orbitales híbridos. Los orbitales atómicos híbridos son los que se superponen en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría molecular.
-
Este concepto fue desarrollado para este tipo de sistemas químicos sencillos, pero el enfoque fue más tarde aplicado más ampliamente, y hoy se considera una heurística eficaz para la racionalización de las estructuras de compuestos orgánicos.
2. Reactividad:
-
En química, la reactividad de una especie química es su capacidad para reaccionar en presencia de otras sustancias químicas o reactivas. Se puede distinguir entre la reactividad termodinámica y la reactividad cinética. La primera distingue entre sí la reacción está o no favorecida por entalpía (competencia entre energía y entropía), es decir si es una reacción espontánea o no. La segunda decide si la reacción tendrá lugar o no en una escala de tiempo dada.
-
Existen reacciones termodinámicamente favorables pero cinéticamente impedidas, como la combustión de grafito en presencia de aire. En casos así, la reacción se dará de una forma muy lenta o, directamente, no se producirá. Si una reacción se encuentra bloqueada cinéticamente, es posible lograr que se produzca alterando las condiciones de reacción o utilizando un catalizador.
3. Polaridad:
-
Es una propiedad de las moléculas que representa la separación de las cargas eléctricas en la misma molécula (consultar también dipolo eléctrico). Esta propiedad está íntimamente relacionada con otras propiedades como la solubilidad, el punto de fusión, el punto de ebullición, las fuerzas intermoleculares, etc.
-
Las moléculas antipáticas tienen regiones polares y regiones apolare, de manera que una parte de la molécula (la polar) interacciona con el agua y la otra (la apolar).
4. Mágnetismo:
-
Es un fenómeno físico por el cual los objetos ejercen fuerzas de atracción o repulsión sobre otros materiales. Hay algunos materiales conocidos que han presentado propiedades magnéticas detectables fácilmente como el níquel, hierro, cobalto y sus aleaciones que comúnmente se llaman imanes. Sin embargo todos los materiales son influidos, de mayor o menor forma, por la presencia de un campo magnético.
-
El magnetismo también tiene otras manifestaciones en física, particularmente como uno de los 2 componentes de la radiación electromagnética, como por ejemplo, la luz.
5. Equidistante:
-
Que equidista, que está a la misma distancia de un punto o entidad que otro.
-
Es cuando 2 o más puntos tienen la misma distancia entre ellos.
6. Carga Parcial:
-
Es una carga con valor absoluto de menos de uno carga elemental unidad (es decir, más pequeña que la carga de electrón). Las cargas parciales son creado debido a la distribución asimétrica de electrones en vínculos químicos. Las cargas parciales que resultan son una característica solamente de zonas dentro de la distribución, y no la ensambladura en su totalidad.
-
La carga que quedaría en un átomo cuando todos los ligados son removidos hemolíticamente.
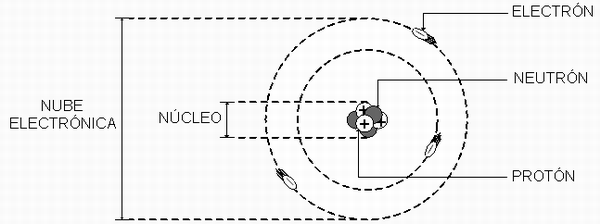
7. Nubes electrónicas:
-
Se denomina a la parte externa de un átomo, región que rodea al núcleo atómico, y en la cual orbitan los electrones.
-
Es el conjunto de electrones (con carga negativa) que están unidos al núcleo de un átomo. Los electrones al unirse desprenden una pequeña porción de carga negativa y de esta se forma la nube de electrones.
8. Punto de Ebullición:
-
es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra.
-
Se suele definirse al punto de ebullición como el instante en el cual se produce el cambio de estado de una materia que pasa de líquido a gaseoso.
9. Catión:
-
Es un ion con carga eléctrica positiva, es decir, que ha perdido electrones. Los cationes se describen con un estado de oxidación positivo. En términos químicos, es cuando un átomo neutro pierde uno o más electrones de su dotación original, éste fenómeno se conoce como ionización.
-
Los cationes se especifican como un estado de oxidación positivo que se da cuando un elemento entra en contacto con el oxígeno, esto sucede con los componentes metálicos expuestos al roce con oxígeno y agua.
10. Punto de Fusión:
-
Es la temperatura a la cual un sólido pasa a líquido a la presión atmosférica. Durante el proceso de cambio de estado de una substancia pura, la temperatura se mantiene constante puesto que todo el calor se emplea en el proceso de fusión.
-
Es la temperatura a la cual se encuentra el equilibrio de fases sólido-líquido, es decir la materia pasa de estado sólido a estado líquido, se funde.
11. Electronegatividad:
-
Es una medida de la capacidad de un átomo (o de manera menos frecuente de un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula.
-
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su capacidad para atraerlos. Pauling la definió como la capacidad de un átomo en una molécula para atraer electrones hacia así.
12. Anión:
-
Es un ion que dispone de carga negativa. Esto se produce como consecuencia de haber ganado determinados electrones.
-
Es un ion (o ión) con carga eléctrica negativa, es decir, que ha ganado electrones.
13. Orbital:
-
Se define como el espacio (volumen) de mayor densidad electrónica (es decir donde es más alta la probabilidad de encontrar al electrón). los orbitales adoptan distinta formas espaciales.
-
Se puede decir que es una zona del espacio donde hay una gran probabilidad, casi mayor del 90%, de encontrar al electrón, lo que supone poder considerar al electrón o electrones, como una nube indefinida cargada que gira en torno al núcleo, donde hay mayor densidad en las zonas donde la probabilidad de encontrar al electrón, es mayor.
14. Electrostática:
-
Parte de la electricidad que estudia las leyes que rigen la interacción de cargaseléctricas en reposo, sus campos eléctricos y potenciales.
-
El estudio de las cargas eléctricas en equilibrio. La carga eléctrica es la propiedad de la materia responsable de los fenómenos electrostáticos, cuyos efectos aparecen en forma de atracciones y repulsiones entre los cuerpos que la poseen.
15. Energía reticular:
-
Es la energía que se obtendría de la formación de un compuesto iónico a partir de sus iones gaseosos.
-
Es la energía que se necesita para poder separar de manera completa un mol de un compuesto de tipo iónico en sus respectivos iones gaseosos.
16. Solubilidad:
-
es una medida de la capacidad de disolverse de una determinada sustancia (soluto) en un determinado medio (solvente).
-
Es la cualidad de soluble (que se puede disolver). Se trata de una medida de la capacidad de una cierta sustancia para disolverse en otra.
17. Halogenuro:
-
Es un compuesto binario en el cual una parte es un átomo halógeno y la otra es un elemento, catión o grupo funcional que es menos electronegativo que el halógeno.
-
Compuesto resultante de la combinación de un halógeno con otro elemento. Halogenuro de ácido o de acilo Compuesto orgánico en el que el grupo -OH del radical carboxilo es sustituido por un halógeno.
















18. Iones Poli atómicos:
-
Es un ion compuesto por dos o más átomos covalentemente enlazados o de un complejo metálico que puede considerarse como una sola unidad en el contexto de química de ácidos y bases o en la formación de sales.
-
Estos iones también se definen como una especie química, ya sea un átomo o una molécula respectivamente con su cargada eléctrica. Esto se debe a que ha ganado o perdido electrones en una reacción química. Los iones cargados negativamente producidos por la ganancia de electrones son aniones, y los cargados positivamente como consecuencia de la pérdida de electrones, son cationes.
19. Estructura Cristalina:
-
Un sólido cristalino, o cristal, es una ordenación periódica de estructuras idénticas.
-
La estructura cristalina es la forma sólida de cómo se ordenan y empaquetan los átomos, moléculas, o iones. Estos son empaquetados de manera ordenada y con patrones de repetición que se extienden en las tres dimensiones del espacio. La cristalografía es el estudio científico de los cristales y su formación.
20. Enlace metálico:
-
Es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
-
El enlace metálico ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos pierden electrones de sus capas más externas, que se trasladan más o menos libremente entre ellos, formando una nube electrónica (también conocida como mar de electrones).
21. Elemento:
-
Es un tipo de materia constituida por átomos de la misma clase.
-
Es un átomo con características físicas únicas, aquella sustancia que no puede ser descompuesta mediante una reacción química, en otras más simples.
22. Molécula:
-
Se llama molécula a un conjunto de al menos dos átomos enlazados covalentes que forman un sistema estable y eléctricamente neutro.
-
Es un conjunto de átomos unidos unos con otros por enlaces fuertes. Es la expresión mínima de un compuesto o sustancia química, es decir, es una sustancia química constituida por la unión de varios átomos que mantienen las propiedades químicas específicas de la sustancia que forman.
23. Fragilidad:
-
Más propiamente como la capacidad de un material de fracturarse con escasa deformación. Por el contrario, los materiales dúctiles o tenaces se rompen tras sufrir acusadas deformaciones, generalmente de tipo deformaciones plásticas.
-
Por el contrario, los materiales dúctiles o tenaces se rompen tras sufrir acusadas deformaciones, generalmente de tipo deformaciones plásticas. La fragilidad es lo contrario de la tenacidad y tiene la peculiaridad de absorber relativamente poca energía, a diferencia de la rotura dúctil.
24. Molécula de cloro:
-
Es un gas amarillo verdoso, más pesado que el aire, soluble en agua y produce irritación en las mucosas de nariz, garganta y pulmones.
-
Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida.
25. Electrones de valencia:
-
Son los electrones que se encuentran en los niveles de energía del átomo, siendo estos los responsables de la interacción entre átomos de distintas especies o entre los átomos de un mismo orbital.
-
Estos electrones, conocidos como "electrones de valencia", son los que presentan la facilidad de formar enlaces.
26. Estado sólido:
-
Es el estudio de los materiales sólidos, sean de base molecular, metálica, cristalina o cerámica del estado sólido inorgánico, y ha sido impulsada fuertemente por la tecnología.
-
Se caracterizan por tener forma y volumen constantes, Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
27. Binario:
-
Son sin duda alguna uno de los elementos más importantes.
-
Es un compuesto químico formado por átomos de sólo dos elementos, como en el caso del agua, compuesta por hidrógeno y oxígeno.
28. Grupo electrónico:
-
Grupo de electrones de valencia que determina la energía electrónica de un átomo central, puede ser un enlace sencillo, doble o uno triple o un par no compartido.
29. Gases nobles:
(Raros) elementos del grupo VIIIA de la tabla periódica. Primero se le dio el nombre de gases inertes He, Ne, Ar, Kr, Xe y Rn.
30. Mezcla:
-
Muestra de materia que se compone de cantidades variables de dos o más sustancias que conserva su identidad y propiedades.













Si tienes problemas para ver la definición porque la imagen esta sobre ella, solo presiona el boton CTRL + (signo de) -
& listo!