
Generalidades de la geometría molecular
La geometría molecular o estructura molecular se refiere a la disposición tridimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. Actualmente, el principal modelo de geometría molecular es la Teoría de Repulsión de Pares de Electrones de Valencia (TRPEV), empleada internacionalmente por su gran predictibilidad.
Las geometrías moleculares se determinan mejor cuando las muestras estan próximas al cero absoluto porque a temperaturas más altas las moléculas presentarán un movimiento rotacional considerable. En el estado sólido la geometría molecular puede ser medida por Difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular.
La posición de cada átomo se determina por la naturaleza de los enlaces químicos con los que se conecta a sus átomos vecinos. La geometría molecular puede describirse por las posiciones de estos átomos en el espacio, mencionando la longitud de enlace de dos átomos unidos, ángulo de enlace de tres átomos conectados y ángulo de torsión de tres enlaces consecutivos.
La geometría molecular puede predecirse fácilmente basándonos en la repulsión entre pares electrónicos. En el modelo de RPECV, [Valence Shell Electron Pair Repulsion Theory (VSEPR)] los pares de e- alrededor de un átomo se repelen entre sí, por ello, los orbitales que contienen estos pares de e-, se orientan de forma que queden lo más alejados que puedan unos de otros.
Definición
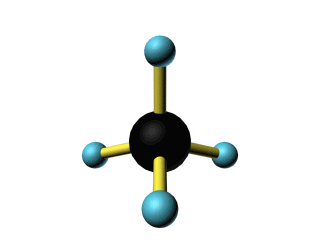
La Teoría de Repulsión de Pares de Electrones de Valencia ( TREPEV, teoría RPECV o teoría VSEPR) es un modelo utilizado en química para predecir la geometría molecular de las moléculas basado en el grado de repulsión electrostática de los pares de electrones. También es conocida con el nombre de Teoría Gillespie - Nyholm por sus dos principales desarrolladores.
La premisa de ésta teoría es que los pares de electrones de valencia alrededor de un átomo se repelen mutuamente, por lo tanto, adoptan una disposición espacial que minimiza ésta repulsión determinándose así la geometría molecular.
Esta idea de establecer una correlación entre la geometría de una molécula y el número de electrones de valencia se presentó por primera vez en 1940 por Nevil Sidgwick y Herbert Powell de la Universidad de Oxford. Años más tarde, en 1957 , Ronald Gillespie y Ronald Sydney Nyholm del University College London refinaron el concepto construyendo una teoría detallada que permitía elegir, entre varias alternativas geométricas, la más adecuada para una molécula determinada.
Teorías de la Repulsión de los pares de electrones de valencia.
* Según esta teoría se establece la estructura de Lewis y se cuentan los pares electrónicos, tanto los compartidos (los que forman enlace o enlazantes) como los solitarios (los no enlazantes, los que no forman enlace).
* La geometría molecular viene determinada por la repulsión electrostática entre los pares de electrones del átomo central de la molécula, es decir, la orientación o disposición de estos pares de electrones es tal que la repulsión entre ellos es mínima.
* El poder de repulsión no es igual entre todos los pares de electrones, los pares no enlazantes, sin compartir o solitarios tienen mayor poder de repulsión, por ello, la repulsión más intensa se da entre estos pares, luego entre un par sin compartir y uno enlazante o compartido, y la menor se establece entre pares compartidos o enlazantes.
Aplicación de la teoría de la repulsión




Diferentes tipos de Geometria Moleculares

La geometría molecular o estructura molecular se refiere a la disposición tridimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc.
Geometria Molecular e iones sencillos
La teoría RPECV da una buena aproximación de la forma y estructura de muchas moléculas, que se complementa con otras aportaciones como la teoría de la hibridación o teoría de orbitales híbridos (OH).
En la tabla inferior aparecen varias moléculas sencillas, con algunas de las formas más comunes.

Tipos de sustancias y sus propiedades
Las sustancias metálicas tienen puntos de fusión variables, desde bajos hasta altos, pero son todas sólidas a temperatura ambiente, con la excepción del mercurio. Su dureza también es variable. Forman estructuras cristalinas regulares. Son sustancias que conducen bien la corriente eléctrica y no son solubles en ningún líquido.
Las sustancias covalentes tienen puntos de fusión muy altos, por lo que en todos los casos son sólidas a temperatura ambiente, formando estructuras cristalinas regulares. Son muy duras, insolubles en cualquier líquido y no conductoras de la corriente eléctrica.
Las sustancias iónicas tienen puntos de fusión medios o altos, siendo siempre sólidas a temperatura ambiente, formando también estructuras cristalinas regulares. Tienen una dureza media, y son solubles en mayor o menor medida en agua. En estado sólido no conducen la corriente eléctrica, pero sí lo hacen al fundirlas o al disolverlas en agua.
Las sustancias moleculares tienen puntos de fusión bajos, pudiendo ser sólidas, líquidas o gaseosas a temperatura ambiente. En estado sólido pueden forman estructuras cristalinas, o masas sólidas sin formas regulares. Son sustancias blandas, con solubilidad variable y que no conducen la corriente eléctrica.
Metal
se denomina metal a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos en temperaturas normales (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución.

Compuesto Ionicos
Un compuesto iónico es un compuesto químico formado por dos sustancias con una diferencia significativa en suselectronegatividades. Se forma preferentemente cuando metales de los grupos I A y II A se unen con los no metales de los grupos VI A y VII A.
Los compuestos iónicos tienen las propiedades siguientes:
· A temperatura ambiente (25 °C) son sólidos cristalinos, duros y frágiles.
· Poseen altos puntos de fusión.
· En estado anhidro no conducen la corriente eléctrica, pero cuando se calientan al estado de fusión (si no se descomponen), sí la conducen.
· Muchos compuestos iónicos se disuelven en disolventes muy polares (como el agua) y, cuando lo hacen, la solución es eléctricamente conductora.

Compuestos moleculares
Polar y No Polar
Moléculas Polares: Los enlaces formados por átomos distintos con grandes diferencias de electronegatividad, forman moléculas polares. La molécula es eléctricamente neutra en su conjunto por tener igual de partículas positivas y negativas, pero no existe simetría en la distribución de la electricidad.
Aquellas moléculas cuyos centros de cargas positiva no coinciden con la carga negativas, se denomina moléculas polares, llamándose polar al enlace en el cual un par de electrones de la configuración electrónica externa no está igualmente compartido por los dos átomos.
De este modo, tanto los enlaces iónicos, como los enlaces covalentes pueden formar moléculas polares.
Moléculas no Polares: Cuando se forman en un enlace covalente entre átomos iguales, la molécula es neutra es decir, tiene carga eléctrica cero; por ejemplo: H2, O2, Cl2.



En este tipo de enlace no hay cambio en el número de oxidación de los átomos debido a que sus electrones compartidos son equidistantes.
Los enlaces covalentes en los cuales los electrones se comparten por igual se les llama enlaces covalentes no polares.
En estos enlaces covalentes entre átomos iguales sus elementos quedan equidistantes y su molécula es no polar
Sustancia de Red Covalente
Muchos compuestos químicos están formados por enlaces mixtos. Siendo el enlace iónico y el enlace covalente tipos extremos de interacción electrónica, muchas moléculas están formadas por la combinación de ambos enlaces.
Para encontrar el tipo de enlace que tiene cada compuesto, se necesita considerar la parte parcial iónica y la parte parcial covalente, porque la mayoría de los enlaces son de los dos tipos.
Puesto que no existen dos elementos que tengan la misma configuración eléctrica, se puede deducir que cualquiera molécula está formado por átomos diferentes y por tanto puede formar moléculas polares.
La escala de electronegatividades propuesta por Linus Pauling de las reglas a los elementos de modo que es fácil establecer cuál de los dos átomos ejercerá una atracción más intensa sobre un par de electrones compartidos.
Un enlace polar es aquel en el cual un par de electrónico compartido es más atraído por uno de los átomos. Esto ocasiona que uno de los extremos de la molécula adquiera una carga parcial positiva y el otro extremo de la molécula adquiera una carga parcial positiva y el otro extremo de la molécula adquiera una carga parcial negativa.

fuerzas de interacción Molecular
La diferencia entre un enlace covalente e interacciones débiles no covalentes es que los enlaces covalentes son los responsables de las estructuras primarias, definen la composición e identidad de cada biopolímero y las "configuraciones" que adopta cada grupo molecular, mientras que las interacciones débiles no covalentes son las responsables de la complejidad de las conformaciones que caracterizan la arquitectura molecular de las macromoléculas biológicas y los complejos supra estructurales, es decir, las interacciones intermoleculares e intermoleculares, por lo que son fundamentales para las funciones biológicas, pero puede ser mayor la molécula.
Fuerzas de Dispersión o de London
son las interacciones más débiles que se dan entre todo tipo de moléculas, independientemente de que sean o no polares. Una molécula no polar es aquella que no tiene separación de carga en su interior. Sin embargo cuando dos moléculas se acercan, sus nubes electrónicas interactúan, produciendo un dipolo durante un instante. Este dipolo origina a su vez otro dipolo temporal en la molécula vecina. La interacción es tanto mayor cuanto mayor sea la capacidad de la molécula para polarizar sus nubes electrónicas. En general cuanto más grande es la molécula, los electrones están más lejos del núcleo, por tanto la polarización es más fácil. Esto explica porque al aumentar el peso molecular aumenta el punto de ebullición. Este tipo de interacciones disminuye mucho con la distancia.
Todo los que nos rodea es sólido, líquido o gaseoso. Un sólido se caracteriza por tener volumen y forma fijos. Un líquido tiene un volumen fijo y la forma del recipiente que lo contiene. Un gas tiene el volumen y la forma de recipiente.
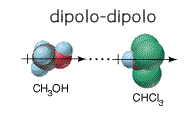
Dipolo Dipolo
consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo. Sólo son eficaces a distancias muy cortas; además son fuerzas más débiles que en el caso ion-ion porque q+ y q- representan cargas parciales. Así como las moléculas polares presentan algún tipo de fuerzas intermoleculares como las ya mencionadas, también las sustancia conformadas por moléculas no polares y los átomos que constituyen los gases nobles experimentan atracciones muy débiles llamadas fuerzas de London.


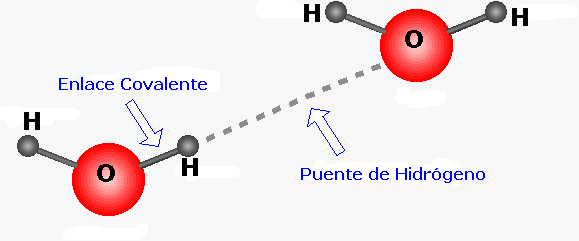
Puente de Hidrogeno
el elevado punto de ebullición del FH, H2O ó NH3, comparado con los compuestos similares del tercer período, ClH, SH2 ó PH3, no se puede explicar únicamente por las fuerzas dipolares, en estas moléculas se produce un nuevo tipo de interacción, el enlace de hidrógeno. Este enlace consiste en la unión intermolecular debida a la atracción entre un átomo de H que se encuentra entre dos átomos electronegativos. El H adquiere una carga parcial positiva por estar unido a un átomo muy electronegativo, esta carga parcial positiva puede interaccionar con el par de electrones libre de un átomo vecino, especialmente si este átomo es tan electronegativo que pueda tener carga parcial negativa. El átomo de H es el único capaz de dar lugar a este tipo de interacciones, porque es tan pequeño que permite que B se acerque lo suficiente para interaccionar con la carga parcial positiva.
Ion-Dipolo
esta interacción puede tener lugar de dos maneras: un catión atrae la carga parcial negativa de un dipolo; un anión atrae la carga parcial positiva de un dipolo. Este tipo de fuerzas disminuye con el cuadrado de la distancia. Las interacciones ión-dipolo son las responsables de la hidratación de los cationes en disolución acuosa, es decir, la unión de moléculas de agua en torno a un ion central.
Ion-Ion
este tipo de unión se da entre iones. Su fuerza disminuye con la distancia y es la responsable de los elevados puntos de fusión y ebullición de los compuestos iónicos


El enlace Químico
Un enlace químico es las interaccion entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos. Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace.
Concepto

Tipos de enlaces químicos
Enlaces Iónico
Enaces Covalente
Enlaces Metálico
Enlaces Molecular
Covalente Polar
Covalente No polar
Enlace Iónico
consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo; este tipo de enlace se produce entre un no metal (electronegativo) y un metal (electropositivo). Los compuestos iónicos estado sólido forman estructuras reticulares cristalinas. Los dos factores principales que determinan la forma de la red cristalina son las cargas relativas de los iones y sus tamaños relativos. Existen algunas estructuras que son adoptadas por varios compuestos, por ejemplo, la estructura cristalina del cloruro de sodio también es adoptada por muchos haluros alcalinos y óxidos binarios.
-NaNO3 nitrato de sodio
-Na2CO3 carbonato de sodio
-KMnO4 manganato de potasio
-NaHCO3 bicarbonato de sodio
-FeCl3 cloruro de hierro
Ejemplo de
compuestos Ionicos
Enlace Covalente Polar
En la mayoría de los enlaces covalentes, los átomos tienen diferentes electronegatividades, y como resultado, un átomo tiene mayor fuerza de atracción por el par de electrones compartido que el otro átomo. En general, cuando se unen dos átomos no metálicos diferentes, los electrones se comparten en forma desigual. Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar.
Ejemplos
-CH4 metano
-CH3-NH-CH3 aminas
-NH3 amoniaco
-CO2 dióxido de carbono
-N2O oxido hidróxido
-NO oxido nítrico
-HF fluoruro de hidrogeno
Enlaces Covalentes No Polar
Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia de electronegatividad es cero, entonces se forma un enlace covalente no polar. El enlace covalente no polar se presenta entre átomos del mismo elemento o entre átomos con muy poca diferencia de electronegatividad. Un ejemplo es la molécula de hidrógeno, la cual está formada por dos átomos del mismo elemento, por lo que su diferencia es cero.
Ejemplo
CH4 (metano)
CO2 (dióxido de carbono)
O2 (oxígeno)
N2 (nitrógeno)
F2 (flúor)
H2 (hidrógeno)
Cl2 (cloro)
Enlaces electro Covalente
son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble.
Molécula de cloro (Cl2)
Molécula de Agua (H2O)
Metano (CH4)
Molécula de Oxígeno (O2)
Molécula de Hidrógeno (H2)
Molécula de Flúor (F2)
Amoniaco (NH3)
Trióxido de Azufre (SO3)
Bióxido de Carbono (CO2)
Enlaces Metalicos
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo. En este tipo de estructura cada átomo metálico está dividido por otros once átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales y . Este enlace sólo puede estar en sustancias en estado sólido

Apuntes Teóricos

Peróxido de Rubidio Rb2O2
Oxido de aluminio Al2O3
Oxido de Calcio CaO
Hidruro de Litio LiH
Hidruro Ferroso FeH2
Hidróxido de Aluminio Al(OH)3
Hidróxido de Cinc Zn(OH)2
Hidruro de radio RaH2
Generalidades de la geometría molecular
El enlace químico
Ejemplo
Enlaces Moleculares
Un enlace molecular, o covalente, se forma cuando los átomos se unen intercambiando pares de electrones. Este intercambio puede ocurrir de un átomo a otro, o de un átomo a otro enlace molecular. A diferencia de los compuestos Iónicos, los compuestos moleculares están formados por unidades moleculares discretas. Por lo regular están formados por elementos no metálicos. Sin embargo una similitud es que muchos de los compuestos moleculares son binarios (formado por 2 elementos).
Ejemplo
CO2
H2O
PBR5
Cl2O7
SO3
SO2
CO4
CH4
BBr6
XeFl4

Propiedades de los compuestos de acuerdo al tipo de enlace
Las propiedades físicas de un compuesto dependen principalmente del tipo de enlaces que mantienen unidos a los átomos de una molécula. Éstos pueden indicar el tipo de estructura y predecir sus propiedades físicas. A continuación se darán a conocer los tipos de enlaces que influencian las propiedades de los compuestos químicos.
Propiedades de los compuestos iónicos
De forma general, las propiedades de los compuestos iónicos son:
· Sólidos a temperatura ambiente. Las fuerzas que mantienen unidos los iones son fuertes, y por este motivo a temperatura ambiente el compuesto se halla en estado sólido.
· Forman redes cristalinas altamente ordenadas. Los aniones y cationes tienen posiciones definidas en el espacio, en función del tipo de red cristalina.
· Puntos de fusión y ebullición elevados. Debido a que, como hemos dicho, las fuerzas electrostáticas que mantienen unidos los iones son fuertes, es costoso separarlos. Por este motivo, hay que aportar elevadas temperaturas para fundirlos y para evaporarlos.
· Elevada dureza. También se debe a la fortaleza del enlace, ya que para rayar la superficie del compuesto hay que romper enlaces de los iones superficiales. Sin embargo, podrán ser rayados por compuestos de mayor dureza, como por ejemplo el diamante (el compuesto de mayor dureza, con un 10 en la escala de Mohs).
· Fragilidad. A pesar de su dureza, son frágiles frente a los golpes. ¿Por qué? Porque un impacto puede hacer resbalar unas capas sobre otras y que, de pronto, se vean enfrentados entre sí iones del mismo signo. La repulsión electrostática entre iones del mismo signo fragmenta el cristal.
· No conductores de la corriente en estado sólido. En estado sólido los iones están colocados en posiciones fijas de la red y no presentan movilidad alguna. La falta de movilidad eléctrica hace que no sean conductores.
· Conductores de la corriente eléctrica en estado fundido o disuelto. Puesto que en estado fundido o disuelto los iones ya sí presentan movilidad, a diferencia de lo que ocurre en estado sólido, en estos estados pueden conducir la corriente.
· Insolubles en disolventes apolares.
· Solubles en disolventes polares. Son solubles en disolventes polares como el amoníaco líquido o el agua, pues las moléculas de agua son capaces de rodear los iones y atraerlos electrostáticamente hasta separarlos de la red iónica, fenómeno que se conoce como solvatación. Recordemos que la molécula de agua es un dipolo. Cuanto más estable sea la red, es decir, mayor sea su energía reticular, más difícil será disolverlo porque ser requerirá mayor energía. Por ello, aunque en general digamos que los compuestos iónicos son solubles en agua, algunos de ellos no lo son

Sal
Propiedades de los compuestos covalentes polares
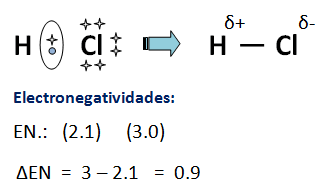


En este enlace el par de electrones no se encuentra distribuido equitativamente entre los átomos. Las moléculas están formadas por átomos que tienen diferente electronegatividad y que se hallan dispuestos de manera que en la molécula existen zonas con mayor densidad de electrones que otras (polo negativo y positivo respectivamente). Este es el caso, por ejemplo, de los gases fluoruro de hidrógeno (HF), cloruro de hidrógeno (HCl), bromuro de hidrógeno (HBr) y ioduro de hidrógeno (HI).
Propiedades de los compuestos covalentes no polares
- Las electronegatividades de los elementos unidos son iguales: se unen átomos del mismo elemento.
- Los electrones de valencia se comparten equitativamente: los átomos tienen la misma electronegatividad y atraen los electrones por igual, por lo que los electrones se mueven alrededor de ambos átomos.
- La partícula que se forma es una molécula no polar: sin cargas eléctricas.
- La diferencia de cargas entre los átomos enlazados es nula.
- Las sustancias con este tipo de enlace se denominan “elementos moleculares”.

Propiedades de los compuestos electro covalentes
-
Pueden presentarse en estado líquido o gaseoso aunque también pueden ser sólidos,Por lo tanto sus puntos de fusión y ebullición no son elevados.
-
Son solubles en solventes apolares.
-
Son malos conductores del calor y la electricidad.

Propiedades de los compuestos metálicos
1. Forman redes cristalinas metálicas, en las cuales los cationes se hallan perfectamente ordenados en el espacio. Los empaquetamientos que presentan, esencialmente, son 3:
o Estructura cúbica centrada en las caras
o Estructura cúbica centrada en el cuerpo
o Estructura hexagonal
· Aunque se trate de empaquetamientos compactos, motivo por el cual los metales suelen presentar dureza, el empaquetamiento cúbico centrado en el cuerpo es el menos compacto de los tres. Esto hace que los metales que lo presentan sean más blandos comparativamente que los otros metales, por ejemplo, el sodio y el litio son tan blandos que se pueden cortar con un cuchillo.
· 2. Presentan una elevada densidad (masa por unidad de volumen) debido, precisamente, al empaquetamiento metálico de los cationes.
· 3. Elevadas conductividades térmica y eléctrica, debido a la gran movilidad de los electrones de valencia, que hemos visto ya en el modelo del gas de electrones y también en la teoría de bandas.
· 4. Gran deformabilidad, porque las capas de cationes se pueden desplazar entre sí sin alterar la estructura. Por ello se pueden estirar en hilos, como el cobre (propiedad que recibe el nombre de ductilidad) y también en láminas, como el aluminio (maleabilidad).
Propiedades de los compuestos moleculares
1. Están formadas por moléculas independientes unidas entre sí por fuerzas débiles llamadas fuerzas intermoleculares.
2. Hallamos sustancias covalentes moleculares que a temperatura ambiente se hallan en estado gaseoso, otras en estado líquido y otras en estado sólido, dependiendo de la fortaleza de dichas fuerzas intermoleculares. No obstante, en general, presentan puntos de fusión y ebullición bajos, menores de 300º en todo caso.
3. Solubilidad dependiente de su polaridad. Los polares son solubles en disolventes polares como agua o etanol, los apolares en disolventes apolares como benceno o hexano.
4. No conducen la corriente eléctrica o son muy malos conductores de la misma, porque los electrones se hallan muy localizados, y son moléculas independientes. Únicamente la conducen los compuestos covalentes muy polares en disolución acuosa que se puedan disociar como electrolitos, como el HCl, cloruro de hidrógeno, que disuelto en agua se disocia como H+ y Cl- y recibe el nombre de ácido clorhídrico (porque libera protones, H+)
