


Apuntes
Teóricos
"Sería posible describir todo científicamente, pero no tendría ningún sentido; carecería de significado el que usted describiera a la sinfonía de Beethoven como una variación de la presión de la onda auditiva." Albert Einstein
Formulación y nomenclatura de los compuestos inorgánicos
Formulación
Es la representación de los elementos que forman parte de un compuesto. Además e eso se representa la proporción de los elementos que intervienen así como el número de átomos que forman la molécula

Nomenclatura

La nomenclatura quimica es un conjunto de reglas que se utilizan para nombrar todas aquellas combinaciones que se dan entre los elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, por sus siglas en inglés) es la máxima autoridad en nomenclatura, la cual se encarga de establecer las reglas correspondientes.

Historia de
la formulación
Antiguamente, los nombres usados para algunos de los compuestos químicos eran antiguas reliquias de los días en los que la alquimia se encontraba en su apogeo. Nombres como "polvo de Algarrotti", "sal de Alembroth", "agua fagedénica" o "colcotar" nada revelaban sobre los componentes de un producto químico, o sobre la relación entre los diferentes productos. Otros nombres como "óleo de tártaro por el campana", "óleo de vitríolo", "mantequilla de antimonio" o flores "de zinc" son aún más indescifrables, porque nos conducen a ideas erradas. Lejos de que se relacionen con el óleo, mantequilla o flores, tales productos son, en su mayor parte, venenos poderosos. Algunos símbolos alquímicos son:
Los científicos pensaron entonces que los nombres de los distintos compuestos, el sistema para nombrarlos debían de expresar la naturaleza química o la composición de la sustancia. Como primer paso, todos los productos químicos fueron divididos en dos clases, los elementos y los compuestos (según Boyle). Los elementos incluían las sustancias más simples o fundamentales "aquellas que los químicos no fueron capaces de descomponer". Los compuestos eran sustancias formadas de dos o más elementos, debiendo ser designados "por la unión de los nombres de aquellos elementos combinados".
Por ejemplo, el oxígeno, el elemento más abundante de la tierra, ocupó un lugar prominente en el nuevo sistema. Su nombre etimológico hace referencia a dos voces griegas que significan generador de ácidos, pues se creía, erradamente, que el oxígeno era un componente de todos los ácidos. Sus compuestos incluían antes de todo y principalmente, los óxidos, formados cuando otro elemento se combina con el oxígeno. Una clase importante de los óxidos era los óxidos ácidos, es decir, sustancias que se disuelven en el agua para formar ácidos. Entre esos están los óxidos de azufre, de carbono, de nitrógeno, de fósforo y de otros no metales. Opuestos a los óxidos ácidos estaban los óxidos de metales, que eran llamados óxidos básicos, y que se disolvían en el agua para formar solucionesalcalinas o básicas. Entre ellos estaban los óxidos de potasio, de sodio, y de otros metales Algunos de esos óxidos básicos, como la cal viva (óxido de calcio), se unen con el agua para formar compuestos más complejos llamados hidróxidos.
El nuevo método de clasificar los productos químicos fue más que un nuevo conjunto de nombres para los compuestos. Nos Ayuda a comprender como un producto puede ser obtenido o utilizado, y lo que tiene en común con los productos relacionados. Llamar a los productos químicos litargirio o galena, poco o nada en los dice sobre su composición química. Pero sus nuevos nombres, óxido de plomo sulfuro de plomo (hoy, sulfuro de plomo (II)) contiene una riqueza deinformación, los nuevos nombres indican que ambos contienen plomo



Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades químicas características de la función ácido, debido a que todos ellos tienen el ion hidrógeno H+; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas. Las principales funciones químicas son: óxidos, bases, ácidos y sales.
Nomenclatura inorgánica
Los iones son partícula que tienen carga, ya sea por la ganancia (-) o pérdida de electrones (+). Cuando una partícula se carga negativamente se denomina anión y cuando lo hace positivamente se denomina catión.
Los iones pueden ser monoatómicos o poli atómicos, de acuerdo con la cantidad de partículas que lo formen. En este aparte nos dedicaremos a estudiar los iones monoatómicos.
Un ion monoatómico es una especie química, ya sea un átomo o una molécula cargada eléctricamente. Esto se debe a que a ganado o perdido electrones.
Los iones cargados negativamente producidos por la ganancia de electrones se conoce como aniones y los cargados positiva mente por la pérdida de electrones se conocen como catones.
Cuando un átomo gana electrones el proceso se llama reducción, cuando pierde electrones se llama oxidación.
Un ion monoatómico es una especie eléctricamente cargada que consiste de sólo un átomo. Un ion poliatómico es un grupo de dos o más átomos que estan químicamente unidos y tiene carga positiva o negativa, son considerados como una unidad en las reacciones químicas. Los iones poliátomicos mas comunes tienen carga negativa, esto significa que el grupo de átomos a ganado electrones, por ejemplo: El ion Fosfato, PO4^3- ha ganado 3 electrones extra además de los que ya tenían los átomos de Fósforo y Oxigeno
Nomenclatura Iónica
Recuerda

Aluminio
Amonio
Bario
Berilio
Cadmio
Calcio
Cesio
Cinc
Cobalto (II)
Cobre (I)
Cobre (II)
Cromo (III)
Escandio (II)
Estaño (II)
Estroncio
Galio (III)
Hierro (II)
Hierro (III)
Lantano (III)
Litio
Magnesio
Manganeso (II)
Mercurio (I)
Níquel (II)
Osmio (II)
Plata
Plomo (II)
Potasio
Sodio
Al3+
NH4+
Ba2+
Be2+
Cd2+
Ca2+
Cs+
Zn2+
Co2+
Cu+
Cu2+
Cr3+
Sc2+
Sn2+
Sr2+
Ga3+
Fe2+
Fe3+
La3+
Li+
Mg2+
Mn2+
Hg22+
Ni2+
Os2+
Ag+
Pb2+
K+
Na+
Nombre
Fórmula
Cationes
Bromuro
Carbonato
Bicarbonato
Cianuro
Clorato
Clorito
Cloruro
Cromato
Dicromato
Fosfato
Fosfato ácido
Fosfato diácido
Fluoruro
Hidróxido
Hidruro
Hipoclorito
Nitrato
Nitrito
Nitruro
Óxido
Perclorato
Permanganato
Peróxido
Sulfato
Bisulfato
Sulfito
Sulfuro
Tiocianato
Yoduro
Br-
CO32-
HCO3-
CN-
ClO3-
ClO-
Cl-
CrO42-
Cr2O72-
PO43-
HPO42-
H2PO4-
F-
OH-
H-
ClO-
NO3-
NO2-
N3-
O2-
ClO4-
MnO4-
O22-
SO42-
HSO4-
SO32-
S2-
SCN-
I-
Nombre
Fórmula
Aniones

Reglas de
Formulación
-
En los compuestos binarios los metales preceden en las fórmulas a los no metales.
De un modo general, el componente electropositivo (catión) debe preceder al electronegativo (anión), aunque en las lenguas latinas, al nombrarlos se sigue el orden contrario.
Ejemplos:
Bromuro de potasio KBr, nitrato de sodio NaNO3, óxido de calcio CaO.
-
Como las moléculas son neutras (carga total nula), el número de oxidación aportado por la parte electronegativa debe ser igual, en valor absoluto, al aportado por la parte electropositiva. Para conseguirlo, el procedimiento más utilizado es intercambiar los números de oxidación, y como norma general, aunque con excepciones, simplificar los subíndices resultantes cuando sea posible.
Ejemplos:
El calcio con número de oxidación 2+, y el cloro con número de oxidación 1-, forman el compuesto CaCl2.
El plomo con número de oxidación 4+, y el oxígeno con número de oxidación 2-, forman el compuesto Pb2O4, que al simplificar, dividiendo por dos, da PbO2.

Sistemas de Nomenclatura según la IUPAC
Sistemático
Nomenclatura también llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia. En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar a usar el sufijo –ico.
K2O, óxido de potasio u óxido potásico.
Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
… -oso cuando el elemento usa la valencia menor: Fe+2O-2, hierro con la valencia +2, óxido ferroso
… -ico cuando el elemento usa la valencia mayor: Fe2+3O3-2, hierro con valencia +3, óxido férrico2
Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
hipo- … -oso (para la menor valencia)
… -oso (para la valencia intermedia)
… -ico (para la mayor valencia)
Cuando entre las valencias se encuentra el 7 se usan los prefijos y sufijos.
hipo- … -oso (para las valencias 1 y 2)
… -oso (para la valencias 3 y 4)
… -ico (para la valencias 5 y 6)
per- … -ico (para la valencia 7):
Ejemplo: Mn2+7O7-2, óxido permangánico (ya que el manganeso tiene más de tres números de valencia y en este compuesto está trabajando con la valencia 7).

Tradicional

Stock
Es por excelencia la más objetiva, lee el compuesto indicando sus datos. Es diría yo la de dificultad intermedia. Consiste en leer el compuesto con sus componentes y sus valencias. Primero se indica el elemento del que hablamos, después, el elemento con el que se ha juntado. Como ya conocemos la valencia del elemento importante, solo necesitamos indicar la del elemento con el que se ha juntado.
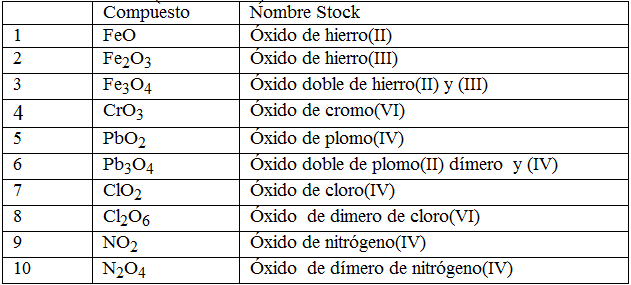
Tipos de compuestos inorgánicos
Los compuestos binarios son aquellos que constan de solo 2 tipos de átomos de elementos, por ejemplo CO2, H2O NaCl, algunos textos de química básica incluyen aquí a los hidróxidos o también llamadas bases Na(OH) ya que la definición también se extiende a que contengan también un enlace simple entre dos pares de iones, sin embargo, la química de Chang y Brown los colocan en la sección de compuestos ternarios. se clasifican según su naturaleza en:
Anhídridos o óxidos ácidos (ya que al mezclarse con agua forman los conocidos ácidos oxacidos)
Binarios
Como su nombre indica, son compuestos formados por la combinación de tres elementos diferentes. Constituyen la materia prima de numerosos procesos industriales (obtecención de celulosa, fertilizantes, potabilización del agua y en purificación de aguas servidas). En lo que sigue se consideran dos tipos distintos de compuestos ternarios: los oxiácidos, las sales neutras de oxiacidos y los hidróxidos metálicos.
Ternarios

Los compuestos cuaternarios son aquellos que poseen un átomo de nitrógeno unido a cuatro sustituyentes alquílicos o arílicos. El nitrógeno en esta situación posee una carga positiva, que se mantiene independientemente del pH del medio. Esta característica es precisamente la que distingue los compuestos cuaternarios de los anfóteros y de las sales de amina.
Cuaternarios
Estequiometria de fórmulas
Conceptos del mol
El mol es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades
Concepto de la masa molar
La masa molar es una propiedad física definida como la masa de una sustancia dada por cantidad de sustancia. Su unidad de medida en el SI es kilogramo por mol, sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos
Concepto de Volumen Molar
El volumen molar de una sustancia, simbolizado Vm, es el volumen de un mol de ésta. La unidad del Sistema Internacional de Unidades es el metro cúbico por mol:³-1 Un mol de cualquier sustancia contiene 6,022 · 10²³ partículas
Concepto de Numero de Avogadro
en un mol de una sustancia cualquiera, donde el mol es una de las siete unidades básicas del Sistema Internacional de Unidades (SI). Su dimensión es el recíproco del mol y su valor es igual a 6,022 141 29(27)×1023 mol−1.2 3 4

Porcentaje de Composición
Uno de los problemas cotidianos con los que se enfrentan los químicos es determinar la clase y cantidad de elementos químicos que forman parte de una muestra analizada y en qué cantidad lo hacen. Los resultados del análisis químico se reportan como porcentajes de cada elemento presente en la muestra. En este sentido se llama composición porcentual.
El cálculo de la composición porcentual a partir de la fórmula molecular es sencillo. Basta calcular la masa molar y dividir entre ella la masa de cada elemento presente en la fórmula.
Al multiplicar el resultado por cien se obtiene el porcentaje.
La fórmula es:
Composición porcentual = masa atómica X número de átomos en la fórmula X 100
___________________________________________
Masa molecular
La suma total de cada uno de los porcentajes en cuanto a composición porcentual debe resultar 100, con un rango de variación de +/‐ 0.2 %
Fórmula empírica y verdadera
La fórmula empírica es una expresión que representa la proporción más simple en la que están presentes los átomos que forman un compuesto químico. Es por tanto la representación más sencilla de un compuesto. Por ello, a veces, se le llama fórmula mínima.
En compuestos covalentes, se obtiene simplificando los subíndices de la fórmula, si ello es posible, dividiéndolos por un factor común. Así, la fórmula empírica de la glucosa (C6H12O6) es CH2O, lo cual indica que por cada átomo de C, hay dos átomos de H y un átomo de O. Los subíndices siempre son números enteros y si son iguales a 1, no se escriben.
En compuestos iónicos la fórmula empírica es la única que podemos conocer, e indica la proporción entre el número de iones de cada clase en la red iónica. En el hidruro de magnesio, hay dos iones hidruro por cada ión magnesio, luego su fórmula empírica es MgH2.
En compuestos no-estequiométricos, como ciertos minerales, los subíndices pueden ser números decimales. Así, el óxido de hierro (II) tiene una fórmula empírica que varía entre Fe0,84O y Fe0,95O,lo que indica la presencia de huecos, impurezas y defectos en la red.
-
Fórmula molecular
La fórmula molecular, indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.
Conocida la composición porcentual de un compuesto o su composición elemental en gramos, se puede determinar su fórmula más simple mediante cálculos elementales.
La fórmula más simple o fórmula empírica de un compuesto es la menor relación entre el número de átomos presentes en una molécula de ese compuesto.
A través de la composición porcentual de un compuesto, puede conocerse su fórmula empírica.
A partir del porcentaje de composición
El análisis de una muestra de un compuesto puro revela que contiene un 27,3% de carbono y un 72,7% de oxígeno en masa. Determinar la fórmula empírica de ese compuesto.
Tal como se advirtió en la parte de "FORMULAS EMPÍRICAS", el paso siguiente consiste en hallar la formula molecular del compuesto, mediante la determinación del número n.
Para ello se nos deben proporcionar unos datos necesarios y suficientes.
Ejemplo
Es un método utilizado tanto en química orgánica y química analítica para determinar la composición elemental en forma de la fórmula empírica, de un compuesto orgánico puro, por combustión de la muestra bajo condiciones donde los productos resultantes de la combustión puedan ser analizados cuantitativamente. Una vez que se ha determinado el número de moles de cada producto de la combustión, puede calcularse la fórmula empírica o fórmula empírica parcial del compuesto original.
A partir de datos de análisis por combustión


Las Reacciones Químicas
Concepto
Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les denomina ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.

Componentes de una reacción química
Los componentes de una reacción química.-
Los cambios químicos que llevan implícita una transformación de la estructura atómico-molecular, como en el caso del fraguado del cemento o en la oxidación del hierro.
Los cambios químicos ocurren mediante la existencia de reacciones químicas, pudiéndose definir una reacción química como un proceso en el que unas sustancias se transforman en otras por la reordenación de sus átomos mediante la rotura de unos enlaces en los reactivos y la formación de otros nuevos en los productos.

Tipos de reacciones
Químicas
Las reacciones químicas pueden clasificarse de manera sencilla en cinco grandes grupos. Existen otras clasificaciones, pero para predicción de los productos de una reacción, esta clasificación es la más útil.
Reacciones de Síntesis o Composición
En estas reacciones, dos o más elementos o compuestos se combinan, resultando en un solo producto.
Síntesis Química: la combinación de dos o mas sustancias para formar un solo compuesto.
A + B ---> C
(donde A y B pueden ser elementos o compuestos)
Ejemplo:
Escriba la reacción de síntesis entre el aluminio y el oxígeno.
Solución:
Dos elementos se combinarán para formar el compuesto binario correspondiente. En este caso, el aluminio y el oxígeno formarán el óxido de aluminio. La ecuación que representa la reacción es la siguiente:
4 Al (s) + 3 O2 (g) à 2 Al2O3 (s)
Nota: Es importante recordar los elementos que son diatómicos, los cuales se escriben con un subíndice de 2 cuando no se encuentran combinados y participan en una reacción. Estos son el hidrógeno, nitrógeno, oxígeno, flúor, cloro, bromo y el yodo.
Reacciones de Descomposición o Análisis
Estas reacciones son inversas a la síntesis y son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
Descomposición Química: la formación de dos o mas sustancias a partir de un solo compuesto.
A à B + C
(donde B y C pueden ser elementos o compuestos)
Ejemplo:
Escriba la ecuación que representa la descomposición del óxido de mercurio (II).
Solución:
Un compuesto binario se descompone en los elementos que lo conforman. En este caso, el óxido de mercurio (II) se descompone para formar los elementos mercurio y oxígeno. La ecuación que representa la reacción es la siguiente:
2 HgO (s) à 2 Hg (l) + O2 (g)
Reacciones de Desplazamiento o Sustitución Sencilla
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
Desplazamiento Químico: un elemento reemplaza a otro similar y menos activo en un compuesto.
AB + C à CB + A ó AB + C à AC + B
(dónde C es un elemento más activo que un metal A o un no metal B)
Ejemplo 1:
Escriba la reacción entre el magnesio y una solución de sulfato de cobre (II).
Solución:
El magnesio es un metal más activo que el cobre y por tanto, lo reemplazará en el compuesto, formando sulfato de magnesio. A la vez, el cobre queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
Mg (s) + CuSO4 (ac) à MgSO4 (ac) + Cu (s)
Reacción de doble desplazamiento o intercambio
También llamada de doble descomposición o metátesis, es una reacción entre dos compuestos que generalmente están cada uno en solución acuosa. Consiste en que dos elementos que se encuentran en compuestos diferentes intercambian posiciones, formando dos nuevos compuestos. Estas reacciones químicas no presentan cambios en el numero de oxidación o carga relativa de los elementos, por lo cual también se le denominan reacciones NO – REDOX.
Reacciones de neutralización
son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Reacciones de combustión
La reacción de combustión se basa en la reacción química exotérmica de una sustancia o mezcla de sustancias llamada combustible con el oxígeno. Es característica de esta reacción la formación de una llama, que es la masa gaseosa incandescente que emite luz y calor, que esta en contacto con la sustancia combustible.
La reacción de combustión puede llevarse a cabo directamente con el oxigeno o bien con una mezcla de sustancias que contengan oxígeno, llamada comburente, siendo el aire atmosférico el comburente mas habitual.
La reacción del combustible con el oxígeno origina sustancias gaseosas entre las cuales las más comunes son CO2 y H2O. Se denominan en forma genérica productos, humos o gases de combustión. Es importante destacar que el combustible solo reacciona con el oxigeno y no con el nitrógeno, el otro componente del aire. Por lo tanto el nitrógeno del aire pasará íntegramente a los productos de combustión sin reaccionar
Balance de una reacción química
En una ecuación química, el número de átomos de cada elemento en los reactantes debe ser igual al número de átomos de cada elemento en los productos. A este tipo de ecuación se le conoce como ecuación química equilibrada.
Si se presenta el caso de que el número de átomos no es igual, la ecuación se debe equilibrar o balancear.
Para balancear una ecuación química podemos usar los siguientes métodos:
- Método de tanteo
- Método algebraico
Metodo de Tanteo
Este método es de gran utilidad para balancear ecuaciones sencillas en donde la reacción no es demasiado extensa. De esta manera se puede realizar una inspección de cuantos átomos se encuentran en un lado y cuantos hacen falta para que halla una igualdad al otro lado de la ecuación Para balancear una ecuación en todos lo métodos es utilizando el coeficiente estequiométrico, mas no alterando los subíndices.


Método Algebraico
El método más usado para balancear una ecuación química es el del método algebraico, el cual se vale de cualquier tipo de brujería u operaciones matemáticas que utilicemos para poder resolver las ecuaciones algebraicas que nos generen cada uno de los elementos que forman los compuestos que a su vez son parte de estas ecuaciones. Estas operaciones matemáticas pueden ir desde sumas hasta resolver complejos y algo trolls sistemas de ecuaciones a través de los cuales cumpliremos nuestro objetivo.


Balanceo de ecuaciones Redox
OXIDACIÓN: es cuando un elemento pierde electrones originando que aumente su estado de oxidación.
REDUCCIÓN: es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Por ejemplo: Un cambio de numero de oxidación de +1 a +4 o de -2 a 0 es oxidación. Una cambio de +4 a +1 o de -1 a -3 es reducción.
En una reacción de redox el agente oxidante acepta electrones ( es el que se reduce) y el agente reductorsuministra electrones (es el que se oxida).
Para poder balancear por método de redox es importante recordar como determinar la cantidad de átomos de un elemento en un compuesto, así como determinar la cantidad de número de oxidación de cada elemento y conocer los pasos del método de redox.
PROCEDIMIENTO PARA EL MÉTODO DE REDOX
1.- Verificar que la ecuación este bien escrita y completa.
2.- Colocar los números de oxidación en cada uno de los elementos.
3.- Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
4.- Escribir la diferencia de números de oxidación de un mismo elemento.
5.- Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
6.- Cruzar los resultados
7..- Colocar los resultados como coeficientes en el lugar correspondiente.
8.-Completar el balanceo por tanteo.
9.- Verifica la cantidad de átomos en cada miembro de la ecuación.
10.-En caso de que todos los coeficientes sean divisibles se reducen a su minima expresión.
Es el método de balance de ecuaciones más difícil de aplicar pero en ocasiones es el único posible.
En principio se debe identificar qué especie se oxida y cuál se reduce para plantear las dos semi – reacciones. En segundo lugar se indica cuantos electrones se están perdiendo y cuántos se están ganando.
Dependiendo de cuál sea el medio se balancea la carga con H+ u OH-. Luego se realiza el balance de masa con agua.
Finalmente se balancean los electrones de manera que los que se pierdan sean igual a los que se ganan
Se halla la ecuación final sumando las dos semi – reacciones.
En medio básico se agregan iones hidróxilo (aniones) (OH−) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Pasos para ajustar
1. Escribimos la ecuación sin ajustar (si escribimos la iónica es más rápido, pero no es esencial hacerlo así).
2. Identificamos qué especie se oxida (reductor) y qué especie se reduce (oxidante) a partir del número de oxidación.
3. Escribimos las semirreacciones de oxidación y de reducción.
4. Ajustamos las semirreacciones de
5. Hacemos el mínimo común múltiplo entre las dos semirreacciones para que los electrones se puedan simplificar en el paso siguiente.
6. Obtenemos la ecuación iónica ajustada sumando las dos semirreacciones.
7. Escribimos, finalmente, la ecuación global ajustada. En algunos casos tendremos que acabar de ajustar algunas especies por tanteo.
oxidación y de reducción.