

La ley de las presiones parciales (conocida también como ley de Dalton) fue formulada en el año 1801 por el físico, químico y matemático británico John Dalton. Establece que lapresión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumende la mezcla, sin variar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla.
Ley de Avogrado
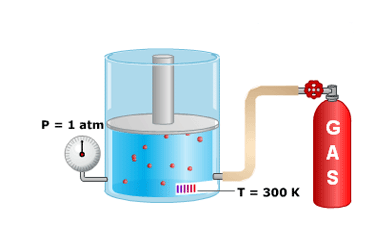
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
El volumen es directamente proporcional a la cantidad de gas:
•Si aumentamos la cantidad de gas, aumentará el volumen.
•Si disminuimos la cantidad de gas, el volumen disminuye.
¿Por qué ocurre esto?
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así:
(el cociente entre el volumen y la cantidad de gas es constante)
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
que es otra manera de expresar la ley de Avogadro.

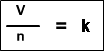
En química, el rendimiento, también referido como rendimiento químico y rendimiento de reacción, es la cantidad de productoobtenido en una reacción química.1 El rendimiento absoluto puede ser dado como la masa en gramos o en moles (rendimiento molar). El rendimiento fraccional o rendimiento relativo o rendimiento porcentual, que sirve para medir la efectividad de un procedimiento de síntesis, es calculado al dividir la cantidad de producto obtenido en moles por el rendimiento teórico en moles:
Para obtener el rendimiento porcentual, multiplíquese el rendimiento fraccional por 100% (por ejemplo, 0,673 = 67,3%).
Uno o más reactivos en una reacción química suelen ser usados en exceso. El rendimiento teórico es calculado basado en la cantidad molar del reactivo limitante, tomando en cuenta la estequiometría de la reacción. Para el cálculo, se suele asumir que hay una sola reacción involucrada.
El rendimiento teórico o ideal de una reacción química debería ser el 100%, un valor que es imposible alcanzar en la mayoría de puestas experimentales. De acuerdo con Vogel, los rendimientos cercanos al 100% son denominados cuantitativos, los rendimientos sobre el 90% son denominados excelentes, los rendimientos sobre el 80% muy buenos, sobre el 70% son buenos, alrededor del 50% sonregulares, y debajo del 40% son pobres.1 Los rendimientos parecen ser superiores al 100% cuando los productos son impuros. Los pasos de purificación siempre disminuyen el rendimiento, y los rendimientos reportados usualmente se refieren al rendimiento del producto final purificado.



Paso 1:

Apuntes
Teóricos
Utilización de fórmulas químicas para determinaciones matemáticas

Calculos utilizando Mol
Calculos utilizando Mol
El mol no es ninguna abreviatura. Mol es una unidad que está relacionada con la cantidad de sustancia que tenemos (átomos, moléculas, partículas en general).
Cuando decimos que tenemos un mol nos referimos a que tenemos una cantidad determinada de partículas. La cantidad de partículas contenidas en un mol viene dada por el número de Avogadro (NA = 6,022 · 1023) (primera definición). Por tanto, tener un mol de agua sería tener el número de Avogadro de moléculas de agua, es decir, tener
602.2003000.0002000.0001000.000 moléculas de agua.
Cálculos de moles.
Lo primero es conocer la masa atómica (si se trata de átomos) o masa molecular (si se trata de compuestos).
Los cálculos los haremos utilizando el factor de conversión, igual que si cambiáramos de unidad.
¿Cuántos moles tenemos en m gramos de un compuesto? Aplicaremos siguiente factor de conversión:
Como m viene en gramos, en el denominador del factor pondremos la masa molecular en gramos, para que se vaya, y en el numerador 1 mol.
Ejemplo. Tengamos 225 g de agua, ¿cuántos moles son? Necesitamos la masa molecular del agua (Magua= 18 u):
¿Cuántos gramos son n moles de un compuesto? Aplicaremos el siguiente factor de conversión:
como n es el número de moles, en el denominador del factor pondremos 1mol y en el numerador la masa de un mol en gramos (masa molecular en gramos).
Ejemplo. Tengamos 15 moles de agua, ¿cuántos gramos son? Necesitamos la masa molecular del agua (Magua= 18 u):




Masa Molar
La masa molar (símbolo M) de una sustancia dada es una propiedad física definida como su masa por unidad de cantidad de sustancia. Su unidad de medida en el SI es kilogramo por mol (kg/mol o kg·mol−1), sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos por mol (g/mol).
Las sustancias puras, sean estas elementos o compuestos, poseen una masa molar intensiva y característica. Por ejemplo, la masa molar aproximada del agua es: M (H2O) ≈ 18 g·mol−1.
¿Como calcular la masa molar?
Halla la masa atómica relativa de un elemento. La masa atómica relativa de un elemento es el promedio de masa, en unidades atómicas, de una muestra de todos sus isótopos. Esta información puede encontrarse en la tabla periódica de elementos. Por ejemplo, para el hidrógeno, la masa relativa es 1,007; para el carbono es 12,0107; para el oxígeno es 15,9994; y para el cloro es 35,453.
Paso 2:
Multiplica por la constante molar. Esta es definida como 0,001 kilogramos por mol, o 1 gramo por mol. Esto convierte unidades atómicas en gramos por moles, haciendo que la masa molar del hidrógeno sea 1,007 gramos por mol, del carbono 12,0107 gramos por mol, del oxígeno 15,9994 gramos por mol y del cloro 35,453 gramos por mol.


Paso 3:
Halla la masa molar de una molécula divalente. Algunos elementos normalmente se encuentran en moléculas de 2 o más átomos de ese elemento. Esto quiere decir que si quieres hallar la masa molar de un elemento que está compuesto por 2 átomos, como el hidrógeno, el oxígeno y el cloro, entonces tienes que encontrar sus masas atómicas relativas, multiplicarlas por la constante de masa molar y luego multiplicar el resultado por 2.
En esos casos, la verdadera masa molar para el elemento es la masa molar para cada átomo multiplicada por el número de átomos de cada molécula: para hidrógeno 1,007 por 2, o 2,014 gramos por mol; para oxígeno, 15,9994 por 2, o 31,9988 gramos por mol; y para el cloro 35,453 por 2, o 70,096 gramos por mol.
Halla la fórmula química para el compuesto. Este es el número de átomos de cada elemento que forma el compuesto (esta información se encuentra en cualquier libro de referencias químicas). Por ejemplo, la fórmula del cloruro de hidrógeno (ácido clorhídrico) es HCl; para la glucosa es C6H12O6. Esto quiere decir que la glucosa contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.

Paso 1:
Halla la masa molar de cada elemento del compuesto. Multiplica la masa atómica del elemento por la constante de la masa por el número de átomos de ese elemento en el compuesto. Debes hacerlo así:
-Para el cloruro de hidrógeno, HCl, la masa molar de cada elemento es 1,007 gramos por mol para el hidrógeno y 35,453 gramos por mol para el cloruro. -Para la glucosa, C6H12O6, la masa molar de cada elemento es de 12,0107 por 6, o 72,0642 gramos por mol para el carbono; 1,007 por 12, o 12,084 gramos por mol para el hidrógeno, y 15,9994 por 6 o 95,0064 gramos por mol para el oxígeno.
Paso 2:
Suma las masas molares de cada elemento en el compuesto. Esto determina la masa molar de cada compuesto. Debes hacerlo así: -Para el cloruro de hidrógeno, la masa molar es 1,007 + 35,453, o 36,460 gramos por mol. -Para la glucosa, la masa molar es 72,0642 + 12,084 + 95,9964, o 180,1446 gramos por mol.
Paso 3:
Calcular la masa Molar de un compuesto




Es el volumen ocupado por un mol de sustancia (sea esta sólida, líquida o gaseosa).
Ejemplo, el volumen molar del agua líquida es el volumen que ocupa 1 mol de moléculas de agua en estado líquido, o sea el volumen que ocupan 18 g de agua. Como la densidad del agua en estado líquido (a 25 ºC) es 1 g/cm3; el volumen molar va a ser: VM(agua) = 18 cm3.
En el caso de los gases, para establecer el volumen molar es necesario además definir las condiciones de presión y temperatura.
Condiciones normales de presión y temperatura (CNPT): corresponden a una presión de 1 atm y a una temperatura de 0 ºC (273,15 K). El volumen molar determinado en estas condiciones se denomina volumen molar normal (VMN).
Utilizando la ecuación de los gases ideales, se puede calcular facilmente el volumen molar normal de un gas:
Condiciones: n (número de moles) = 1 mol
T (temperatura) = 273,15 K
P (presión) = 1 atm
Vmn = n RT = 1 mol x 0,082 atm dm3 x 273,15 K = 22,4 dm3
P 1 atm x mol K
Volumen Molar
Calculos usando el numero avogrado



Utilización de fórmulas químicas para la determinación del Porcentaje de composición de una sustancia.
Determinación de la formula empírica
Una formula empírica es aquella que indica cuales elementos están presentes en un compuesto y su proporción mínima, en números enteros, entre sus átomos. Es importante señalar que NO necesariamente indica el número real de átomos en una molécula determinada.
Para determinar (experimentalmente) la formula empírica de un compuesto se sigue el procedimiento a continuación:
-
El análisis químico que indica el número de gramos de cada elemento presente en determinada cantidad de compuesto.
-
Las cantidades en gramos de cada elemento se convierten en número de moles.
-
Después se determina la fórmula empírica dividiendo cada numero de moles entre el número de moles menor. (se explicará en un ejemplo a continuación)
Tenemos una muestra de 10g de un compuesto
liquido. Que sabemos que contiene hidrógeno y oxígeno.
Masa de H = 0.588 g
Masa de O = 9.411 g
Ahora, dividimos la masa de cada elemento entre su respectiva masa molar, para conocer cuantos moles de cada átomos tenemos en la muestra.
(Masa de elemento) / (Masa Molar)
(0.588 g de H) / (1.00g de H/Mol) = 0.588 Mol
(9.411 g de O) / (16.00g de O/Mol) = 0.588 Mol
Ahora, siguiendo los pasos descritos, dividimos los números de moles (ambos, 0.588 moles) entre el menor de estos dos, ya que son iguales es indiferente entre cual se divide.
Número de H
0.588 mol/0.588 mol = 1
Número de O
0.588 mol/ 0.588 mol = 1
Ahora sabemos que la proporción entre H y O es 1:1. Como dato extra, ahora les diré que el compuesto del que hablamos es el H2O2, pero se les explicará en una publicación próxima como determinar la formula molecular (número real de átomos por molécula) a partir de la fórmula empírica.

Determinación de la formula verdadera
La fórmula mínima o empírica muestra las relaciones de números enteros más simples, mientras que en la fórmula molecular o verdadera se tiene la correcta relación de átomos que conforman un compuesto determinado. Para obtener la fórmula molecular conviene utilizar la siguiente secuencia de pasos.
1. se calcula la fórmula mínima o empírica por el procedimiento aprendido anteriormente.
2. se calcula la masa molecular de la fórmula empírica.
3. se divide la masa molecular verdadera entre la obtenida en el paso 2; de este modo se obtiene un factor.
4. se multiplican los subíndices de la fórmula mínima por el factor obtenido en el paso 3.
Analisis por Combustión
El análisis de combustión es un método utilizado tanto en química orgánica y química analítica para determinar la composiciónelemental en forma de la fórmula empírica, de un compuesto orgánico puro, por combustión de la muestra bajo condiciones donde los productos resultantes de la combustión puedan ser analizados cuantitativamente. Una vez que se ha determinado el número de molesde cada producto de la combustión, puede calcularse la fórmula empírica o fórmula empírica parcial del compuesto original.
El método fue inventado por Joseph Louis Gay-Lussac. Justus von Liebig estudió el método mientras estaba trabajando con Gay-Lussac entre 1822 y 1824, y mejoró el método en los años siguientes a un nivel que podía ser usado como procedimiento estándar para análisis orgánico.
Historia
Sucesos en que ocurren reacciones químicas
Durante la síntesis o composición de sustancias
Una reacción de síntesis' o reacción de combinación es un proceso elemental en el que dos sustancias químicasreaccionan para generar un solo producto. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo. La siguiente es la forma general que presentan este tipo de reacciones:
-
A+B → AB
Donde A y B representan cualquier sustancia química.
Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxi-ácido.
Ejemplos:
-
Na2O(s) + H2O(l) → 2Na(OH)(ac)
-
SO3(g) + H2O(l) → H2SO4(ac)
Otras reacciones de síntesis se dan al combinar un no metal con hidrógeno, para obtener un hidrácido.
Ejemplo:
-
Cl2(g)+ H2(g) → 2HCl(g)
La oxidación de un metal, también es una reacción de síntesis o de combinación.
Ejemplo:
-
4Na(s) + O2(g) → 2Na2O(s) kk
Durante la descomposición o análisis de sustancias
La descomposición química es un proceso que experimentan algunos seres humanos en el que, de modo espontáneo o provocado por algún agente externo, a partir de una sustancia compuesta, se originan dos ó más sustancias de estructura química más simple, Es el proceso opuesto a la síntesis química.
La ecuación química generalizada de una descomposición química es:
AB → A + B , o bien, Reactivo → A + B + ...
Un ejemplo específico es la electrólisis de agua que origina hidrógeno y oxígeno, ambos en estado gaseoso:
2 H2O ( l) → 2 H2 (g) + O2 (g)
La descomposición química es, con frecuencia, una reacción química no deseada, pues la estabilidad de un compuesto es siempre limitada cuando se le expone a condiciones ambientales extremas como el calor, la electricidad, las radiaciones, lahumedad o ciertos compuestos químicos (ácidos, oxidantes, etc). Los casos más frecuentes de descomposición son ladescomposición térmica o termólisis, la electrólisis y la hidrólisis. La descomposición química total de un compuesto origina los elementos que lo constituyen.
Una definición más amplia del término descomposición también incluye la separación de una fase en dos o más fases.
El desplazamiento químico describe la dependencia de los niveles de energía magnética del núcleo atómico con el ambiente electrónico de la molécula.
Veamos la siguiente reacción de desplazamiento
¿Quien es el elemento desplazante? : Fe
¿Quién fue el elemento desplazado? : H
¿Quién es el elemento químico es mas reactivo? : el mas reactivo es el elemento desplazante – Fe
Durante el desplazamiento o sustitución simple de sustancias

En una reacción de doble desplazamiento, dos compuestos intercambian parejas entre sí, para producir compuestos distintos.
El nitrato de plata en solución acuosa reacciona con cloruro de sodio también en solución acuosa para formar el precipitado de cloruro de plata, quedando en solución el nitrato de sodio según la siguiente ecuación:
Durante el doble desplazamiento o intercambio de sustancias
Durante la neutralización de sustancias
La reacción entre un ácido y una base se denomina neutralización. Según el carácter del ácido y de la base reaccionante se distinguen cuatro casos:
ácido fuerte + base fuerte
ácido débil + base fuerte
ácido fuerte + base débil
ácido débil + base débil
En el momento de la neutralización se cumple que elnúmero de equivalentes de ácido que han reaccionado (N • V) es igual al número de equivalentes de la base (N' • V'):
N • V = N' • V'
Durante la reacciones de combustión
La reacción de combustión se basa en la reacción química exotérmica de una sustancia o mezcla de sustancias llamada combustible con el oxígeno. Es característica de esta reacción la formación de una llama, que es la masa gaseosa incandescente que emite luz y calor, que esta en contacto con la sustancia combustible. Las reacciones químicas que se utilizan en el estudio de las combustiones técnicas tanto si se emplea aire u oxigeno, son muy sencillas y las principales son:
C + O2 → CO2
CO + 1⁄2 O2 → CO2
H2 + 1⁄2 O2 → H2O
S + O2 → SO2
SH2 + 3⁄2 O2 → SO2 + H2O
Métodos para realizar el balance de una reacción química
Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción.
A + B C + D
método de tanteo
El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en
-
H2SO4 hay 2 Hidrogenos 1 Azufre y 4 Oxigenos
-
5H2SO4 hay 10 Hidrógenos 5 azufres y 20 Oxígenos
-
Para equilibrar ecuaciones, solo se agregan coeficientes a las fórmulas que lo necesiten, pero no se cambian los subíndices.
Ejemplo: Balancear la siguiente ecuación
-
H2O + N2O5 NHO3
-
Aquí apreciamos que existen 2 Hidrógenos en el primer miembro (H2O). Para ello, con solo agregar un 2 al NHO3 queda balanceado el Hidrogeno.
-
H2O + N2O5 2 NHO3
-
Para el Nitrógeno, también queda equilibrado, pues tenemos dos Nitrógenos en el primer miembro (N2O5) y dos Nitrógenos en el segundo miembro (2 NHO3)
-
Para el Oxígeno en el agua (H2O) y 5 Oxígenos en el anhídrido nítrico (N2O5) nos dan un total de seis Oxígenos.
Se basa en el planteamiento de un sistema de ecuaciones en la cual los coeficientes estequiométricos participan como incógnitas, procediendo luego despejar estas incógnitas. Es posible sin embargo que muchas veces queden planteados sistemas de ecuaciones con más incógnitas que ecuaciones, en esos casos la solución se halla igualando a uno de cualquiera de los coeficientes a 1 y luego despejando el resto en relación a él. Finalmente se multiplican todos los coeficientes por un número de modo tal de encontrar la menor relación posible entre coeficientes enteros
Método algebraico
Balanceo de las ecuaciones Rdox
Una reacción de óxido-reducción no es otra cosa que una pérdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor electricidad, etc.) En una reacción si un elemento se oxida, también debe de existir un elemento que se reduce.
OXIDACIÓN: es cuando un elemento pierde electrones originando que aumente su estado de oxidación.
REDUCCIÓN: es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Por ejemplo: Un cambio de número de oxidación de +1 a +4 o de -2 a 0 es oxidación. Una cambio de +4 a +1 o de -1 a -3 es reducción.
En medio ácido
Para llevar a cabo el ajuste de una reacción redox en medio básico, se procede esencialmente como en el caso ya comentado del ajuste de una reacción redox en medio ácido.
La diferencia fundamental estriba en el ajuste de los oxígenos y los hidrógenos de las semirreacciones que lo requieran. Así, resumiremos los pasos restantes y nos extenderemos un poco más en este punto de ajuste de oxígenos e hidrógenos.
1. Escribimos la ecuación sin ajustar (si escribimos la iónica es más rápido, pero no es esencial hacerlo así).
2. Identificamos qué especie se oxida (reductor) y qué especie se reduce (oxidante) a partir del número de oxidación.
3. Escribimos las semirreacciones de oxidación y de reducción.
4. Ajustamos las semirreacciones de oxidación y de reducción.
Es en este punto donde difiere ligeramente del ajuste en medio ácido.
Así, para ajustar los oxígenos e hidrógenos en medio básico, procederemos del siguiente modo: en el miembro de la semirreacción que presente exceso de oxígenos, añadiremos tantas moléculas de agua como oxígenos hay de más. Después, en el miembro contrario, se añaden los iones hidroxilo necesarios para ajustar completamente la semirreacción. Normalmente, se requieren el doble de iones hidroxilo, OH-, que moléculas de agua hemos adicionado previamente.
5. Hacemos el mínimo común múltiplo entre las dos semirreacciones para que los electrones se puedan simplificar en el paso siguiente.
6. Obtenemos la ecuación iónica ajustada sumando las dos semirreacciones.
7. Escribimos, finalmente, la ecuación global ajustada. En algunos casos tendremos que acabar de ajustar algunas especies por tanteo.
En Medio Basico
+Teóricamente, la ecuación de una reacción redox, como cualquier otra ecuación de una reacción química, podría ajustarse por tanteo. Sin embargo, suelen ser reacciones de suma complejidad, por lo que se ha desarrollado un método sistemático de ajuste de reacciones redoxque recibe el nombre de método ión-electrón. Este método ión-electrón se divide principalmente en siete pasos que hay que realizar en orden para ajustar correctamente la ecuación de una reacción redox.
1. Escribimos la ecuación sin ajustar.
2. Identificamos qué elemento se oxida (semirreacción de oxidación) y qué elemento se reduce (semirreacción de reducción) a partir de los números de oxidación o estados de oxidación de dichos elementos. Para ello usaremos las reglas para la determinación del número de oxidación.Si el número de oxidación de una especie aumenta, se está oxidando y es lasemirreacción de oxidación.Si el número de oxidación de una especie disminuye, se está reduciendo y es lasemirreacción de reducción.
3. Una vez que sabemos qué especie se oxida y qué especie se reduce por el número de oxidación escribimos las correspondientes semirreacciones de oxidación y de reducción. Las especies que intervienen deben escribirse según sea su estado correspondiente, generalmente en disolución acuosa: átomos sueltos, iones o especies moleculares.
4. Ajustamos por separado las dos semirreacciones. Para ello, debemos ajustar tanto el número de átomos como las cargas eléctricas positivas y negativas. Así, en primer lugar se ajustan los átomos que se oxidan o se reducen y después, en este orden: oxígenos, hidrógenos y cargas eléctricas, si bien es posible determinar el número de electrones intercambiados a través de la variación en el número de oxidación de la especie que se oxida o se reduce.Ajuste de oxígenos e hidrógenos en medio ácido. En el miembro de la semirreacción que presenta menor cantidad de átomos de oxígeno, se añade una molécula de agua por cada átomo de oxígeno que falte. Es decir, si faltan cinco oxígenos a la derecha, añadimos cinco moléculas de agua a la derecha. Al introducir agua habremos introducido hidrógenos, que hay que ajustar, añadiendo en el lado contrario tantos protones, H+, como hayamos introducido con las aguas, es decir, el doble de protones que de moléculas de agua.Una vez ajustados los oxígenos y los hidrógenos, tenemos que ver el número de electrones intercambiados. Esto podemos verlo por el cambio en el número de oxidación. Por ejemplo, si en una reacción el nitrógeno pasa de un número de oxidación +2 a +4, cada átomo de nitrógeno habrá perdido 2 electrones. Asimismo, podemos ver el número deelectrones totales intercambiados por balance de cargas. Añadiremos en el lado de la semirreacción que corresponda (el que tenga exceso de carga positiva) los electrones necesarios para que ambos miembros de la semirreacción tengan el mismo número de cargas. Recordemos que:– En la semirreacción de oxidación, los electrones se escriben a la derecha.– En la semirreacción de reducción, los electrones se escriben a la izquierda.
5. Ajuste del número de electrones entre las dos semirreacciones. El número de electrones cedidos por el reductor tiene que ser igual al número de electrones captados por el oxidante. Es decir:Número electrones cedidos por el reductor = Número de electrones captados por el oxidanteAsí, buscaremos el mínimo común múltiplo del número de electrones de las dos semirreacciones, es decir, multiplicamos cada una de ellas por un coeficiente que haga que quede el mismo número de electrones a la izquierda y a la derecha. De este modo, al sumar ambas semirreacciones, estos se simplifican.
6. Escribimos la ecuación iónica ajustada. Para ello, una vez que hemos multiplicado las semirreacciones por el coeficiente correspondiente, sumamos ambas semirreacciones. Loselectrones, al estar ya en igual número a izquierda y a derecha, se simplifican y desaparecen de la ecuación. En ocasiones también se pueden simplificar protones o moléculas de agua.
7. Escribimos la ecuación global o molecular ajustada. Se completan las especies iónicas de la ecuación anterior con los contrariones correspondientes, manteniendo los coeficientes calculados. Puede ser que aparezcan nuevas especies formadas por cationes y aniones “sobrantes” o que algunas especies se tengan que ajustar por tanteo, pero no son especies que intervienen directamente en el intercambio electrónico.Y ya hemos ajustado la reacción redox en medio ácido.
Razones Molares y reactivos limitante
El método de factor molar se basa en la relación del número de moles entre dos sustancias que participan en una reacción química.
*Ejemplo:
Determinar la masa en gramos de SO3 que se producen cuando se tratan 500gr O2 con exceso de SO2.
-
PASO 1: Balancear la ecuación.
-
PASO 2: Determinar el factor molar, que es igual a el número de moles buscados sobre el número de moles conocidos, es decir:
-
PASO 3: Hallar los moles de O2 a partir de 500g O2.
-
PASO 4: Hallar los moles de SO3 a partir de los de O2.
-
PASO 5: Hallamos los gramos de SO3 a partir de los 31.25 mol SO3.


Supongamos que tenemos que preparar 10 pebetes de jamón y queso. Para preparar un pebete se necesitan un pan, una feta de jamón y otra de queso. Hay 10 panes, 10 fetas de queso y 8 de jamón. Podremos preparar solamente 8 pebetes de jamón y queso y ni uno más porque no hay más jamón. Decimos entonces que el jamón es el ingrediente limitante del número de pebetes a preparar.
En una reacción química la situación es similar: una vez se haya consumido uno de los reactivos la reacción se para.
CH4(g) + 2O2(g) = CO2(g) + 2H2O (l)
Así si queremos obtener 2 moles de agua necesitaremos partir de 1 mol de metano y dos moles de oxígeno (porque la estequiometría de la reacción es 1 moles de metano reaccionan con 2 moles de oxígeno para dar dos moles de agua).
Que pasaría si en lugar de dos moles de oxigeno tenemos solo 1 mol??
Una vez haya reaccionado todo el oxigeno nos quedara sobrando metano sin reaccionar y se habrán obtenido solo un mol de agua, es decir, entonces la reacción se terminara cuando medio (1/2) mol de metano haya reaccionado un mol de oxigeno (todo el oxigeno presente).
Al reactivo que se ha consumido en su totalidad en una reacción química se le denomina reactivo limitante, ya que limita la cantidad de producto formado. Así en el ejemplo anterior el oxigeno era el reactivo limitante, ya que con los 1 mol de oxígeno solo medio mol de metano reacciona (y sobra medio mol de metano)
¿Cómo hacer para saber cuál es el reactivo limitante de una reacción?
Calculando los moles de producto que se obtienen con cada reactivo, suponiendo que el resto de reactivos están en cantidad suficiente. Aquel reactivo que nos dé el menor número potencial de moles de producto es el reactivo limitante. Al resto de reactivos, presentes en mayor cantidad que la necesaria para reaccionar con la cantidad del reactivo limitante, se les denomina reactivos en exceso.
Reactivo Limitante
El rendimiento de una reacción
Estado Gaseoso
Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que este se expanda para ocupar todo el volumen del recipiente que la contiene, con respecto a los gases las fuerzas gravitatorias y de atracción entre particulas resultan insignificantes. Es considerado en algunos diccionarios como sinónimo de vapor, aunque no hay que confundir sus conceptos, ya que el termino de vapor se refiere estrictamente para aquel gas que se puede condensar por presurización a temperatura constante. Los gases se expanden libremente hasta llenar el recipiente que los contiene, y su densidad es mucho menor que la de los líquidos y sólidos.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la materia puede estar en un estado o en otro diferente: se ha hablado durente la historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son modelos límites ideales y, por tanto, no tienen existencia real.
En los gases reales no existe un desorden total y absoluto, aunque sí un desorden más o menos grande.

En un gas, las moléculas están en estado de caos y muestran poca respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque dejan espacios libres intermedios y están enormemente separadas unas de otras. Por eso es tan fácil comprimir un gas, lo que significa, en este caso, disminuir la distancia entre moléculas. El gas carece de forma y de volumen, porque se comprende que donde tenga espacio libre allí irán sus moléculas errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.
Teoria cinética de los gases
La teoría cinética de los gases explica las características y propiedades de la materia en general, y establece que el calor y el movimiento están relacionados, que las partículas de toda materia están en movimiento hasta cierto punto y que el calor es una señal de este movimiento.
La teoría cinética de los gases considera que los gases están compustos por las moléculas, partículas discretas, individuales y separadas. La distancia que existe entre estas partículas es muy grande comparada con su propio tamaño, y el volumen total ocupado por tales corpúsculos es sólo una fracción pequeña del volumen ocupado por todo el gas. por tanto, al considerar el volumen de un gas debe tenerse en cuenta en primer lugar un espacio vacío en ese volumen.
El gas deja muchos espacios vacíos y esto explica la alta comprensibilidad, la baja densidad y la gran miscibilidad de unos con otros.

Hay que tener en cuenta que:
1. No existen fuerzas de atracción entre la moléculas de un gas.
2. Las moléculas de los gases se mueven constantemente en línea recta por lo que poseen energía cinética.
3. En el movimiento, las moléculas de los gases chocan elásticamente unas con otras y con las paredes del recipiente que las contiene en una forma perfectamente aleatoria.
4. La frecuencia de las colisiones con las paredes del recipiente explica la presión que ejercen los gases.
5. La energía de tales partículas puede ser convertida en calor o en otra forma de energía. pero la energía cinética total de las moléculas permanecerá constante si el volumen y la temperatura del gas no varían; por ello, la presión de un gas es constante si la temperatura y el volumen no cambian.
Unidad de presión, volumen y temperatura
Una de las propiedades más importantes de un gas es la presión, la cual se ejerce igualmente sobre todas las partes del recipiente que lo contenga. La Presión se define como la fuerza ejercida por unidad de área, o sea:
P=F/a
Se denomina volumen de un cuerpo al espacio ocupado por dicho cuerpo. Las unidades más utilizadas para medir volúmenes son el centímetro cúbico, el mililitro y el litro. Para los gases, esta última unidad es la más empleada.

La temperatura es el grado de intensidad del calor y se mide utilizando diversas propiedades, entre las cuales la más empleada es la dilatación térmica.
Un gas puede licuarse por enfriamiento o por compresión (aplicando presiones altas). Sin embargo, este último proceso sólo puede verificarse cuando el gas se encuentra a temperaturas por debajo de la denominada Temperatura Crítica, la cual es la temperatura por encima de la cual es imposible licuar un gas por presión. En consecuencia, a temperatura mayores que la Crítica, una sustancia sólo puede existir como gas, no importa cuán alta sea la presión que se ejerza sobre ella.

Propiedades de los gases
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
Expansion
Un gas ocupa todo el volumen del recipiente que lo contiene debido a la alta energía cinética traslacional de las moléculas.
¿Porque el aire que es una mezcla gaseosa, no se expande por todo el universo?
La explicación es simple, la fuerza de atracción gravitatoria impide que algún cuerpo material pueda abandonar la orbita terrestre, salvo que supere la velocidad mínima para vencer la gravedad que es 11 Km/s, que las moléculas de aire no pueden adquirir en forma natural.
Forma
Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
los gases los cuales tienen sus moléculas muy separadas y que en general son altamente compresibles bajo condiciones de presión y temperatura normales.
Compresibilidad
Volumen
Son las dimensiones del espacio que ocupa un gas. En un sistema cerrado, el gas ocupa todo el volumen del sistema. Asi por ejemplo, cuando un gas es metido a un recipiente, se expande uniformemente para ocupar todo el recipiente. Cuando un gas es sacado del recipiente al ambiente tenderá a expandirse por la atmósfera
Presión
Fuerza dividida entre el área que ejercen las moléculas de gas al chocar unas con otras y con las paredes de un sistema. A la vez, por la 3ª ley de Newton de Acción y Reacción, también es la fuerza por unidad de área que ejercen las paredes del sistema sobre el gas.
Densidad
Para los gases, la densidad de referencia habitual es la del aire a la presión de 1 atm y la temperatura de 0 °C.
Miscibilidad
Los gases tienen una alta miscibilidad, lo que significa que sus particulas se entremezclan completa y uniformemente con otros gases.


LEYES
GASES
De los
Las primeras leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética.
Ley de Boyle-Mariotte
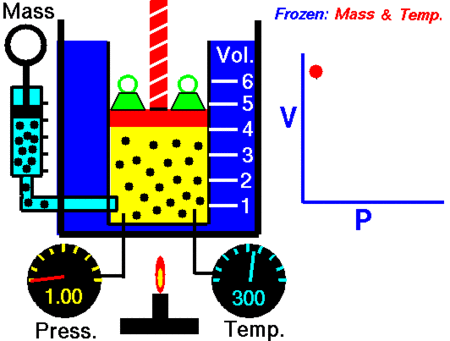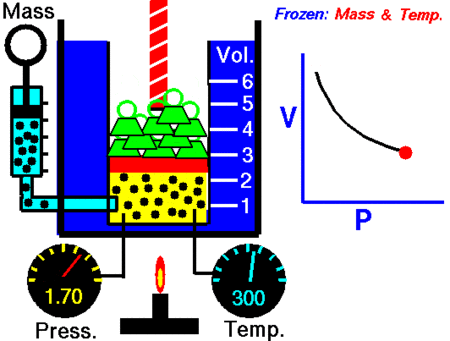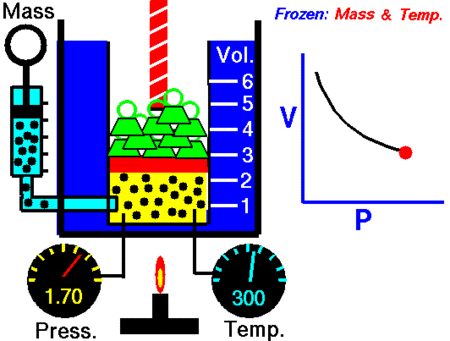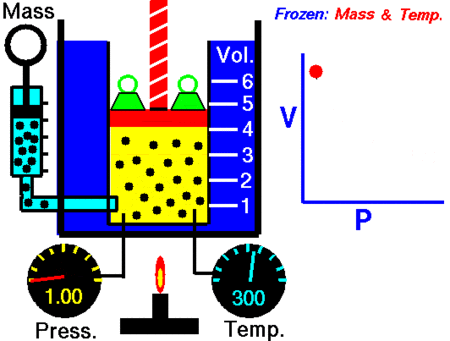
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandés Robert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y lapresión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.
o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
PV=K
donde K es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor
Ley de Charles
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y, observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el gas, el volumen disminuía.
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que a presión constante, el cociente entre el volumen y la temperatura de una cantidad fija de gas, es igual a una constante.
Matemáticamente podemos expresarlo así:
V/T=K
Ley de Gay-Lussac
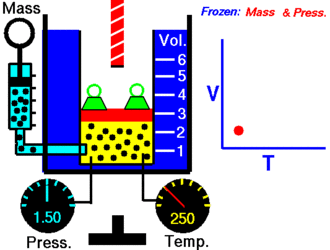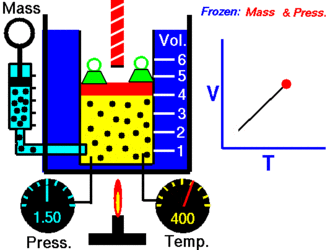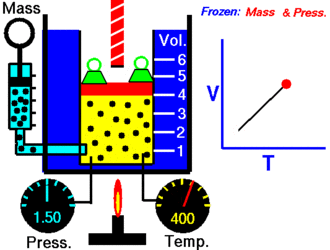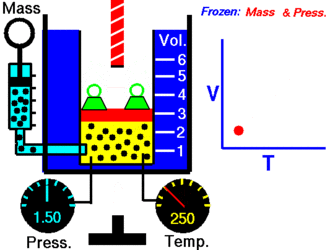
Esta Ley fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece que la presión de un volumen fijo de gas, es directamente proporcional a su temperatura.
¿Por qué ocurre esto?
Al aumentar la temperatura, las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
K/T=K
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si aumentamos la temperatura hasta un nuevo valor T2, entonces la presión se incrementará a P2.
P
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta expresada en Kelvin.

Esta ley establece como enunciado:
"El volumen ocupado por una masa gaseosa, es inversamente proporcional a las presiones y directamente proporcional a las temperaturas absolutas que soportan"
Observa la siguiente imagen a través de la cual se comprueba el enunciado de la presente ley:
De acuerdo con el enunciado, se puede establecer la siguiente expresión matemática:
V1 . P1 = V2 . P2
T1 T2
En donde:
V= Volumen
P= Presión
T= Temperatura


Charles
Ecuación del gas ideal
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptist van Heltmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, aparentemente de manera independiente por August Krönig en 1856 y Rudolf Clausius en 1857. La constante universal de los gases se descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar de un gran número de constantes de gases específicas descriptas por Dmitri Mendeleev en 1874.
En este siglo, los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.
Ley de Graham
La ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.
Siendo V las velocidades y M las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
